NEWS CENTER
新闻中心
干细胞新药IND井喷式受理!国内细胞疗法发展势头强劲。
近年来,我国干细胞临床研究逐步进入规范化发展阶段,取得了较大的进步与发展。目前,我国干细胞备案项目和干细胞IND注册受理项目共近200项,通过新药注册申报途径研发的干细胞临床管线持续增加。
01
临床备案和新药开发的定义
干细胞临床研究备案
干细胞临床研究备案其实就是研究者发起的临床研究,因为我国干细胞技术的发展史上最早是按照第三类医疗技术来管理的(上级管理单位是卫健委),随着管理制度的变化,目前能直接在医院能开展的只有干细胞临床研究,也就是investigator initiated trial (IIT),IIT 研究不是以盈利或药品注册为目的,而是扩展和优化现有疗法,与企业发起临床试验互为补充,更好地推进了药物研究的深度和广度,获得了更多的研究数据,为循证医学提供依据。
·主管单位:国家卫生健康委员会
·可否收费:没法收费
干细胞药物申请
干细胞药物是指按药品注册路径开发的干细胞产品。一般须经历两个阶段:新药临床试验申请(简称IND)和药品上市许可申请(简称NDA)。在美国,FDA单独审评审批细胞制品在内的生物制剂上市许可申请(简称BLA)。
干细胞药品要经过2个步骤,才有可能上市:
第一步:IND-新药临床审批
IND的缩写是Investigational New Drug,意为新药临床试验审批。任**药的产生,首先都必须要进行临床试验(4期),而临床试验也需要药监局进行审批申报,这就是IND申报。
第二步:NDA-新药上市申报
NDA的缩写是New Drug Application,是指新药经过临床试验后,申报注册上市的阶段。在临床试验1期,2期,3期阶段之后,新药研发算是取得了阶段性的成功。然后进入临床试验4期,一般代表药物进入上市阶段,通过了临床试验的新药还需要按要求准备材料,进行注册上市申报,这就是NDA上市申报。通过此NDA申报后才能上市销售,面向患者。
·主管单位:国家药品监督管理局
·可否收费:上市后可收费
02
十月IND注册受理情况
2023年10月,国家药品监督管理局再次彰显了对生物医药创新的坚定支持,共计受理了5款一类新药干细胞产品,其中包括4款人脐带间充质干细胞注射液和1款造血干细胞注射液。
03
我国干细胞临床研究备案状况
2015年7月20日,原国家卫生计生委、原国家食品药品监管总局以国卫科教发〔2015〕48号印发《干细胞临床研究管理办法(试行)》(下文简称《办法》),自发布之日起施行,从此我国干细胞开始走向按药品、技术管理的“双轨制”道路。 “双轨制”道路是指企业的干细胞制剂鼓励按药品申报,由国家药品监督管理局(NMPA)监管;医疗机构主导的干细胞制剂研究,可按医疗技术进行管理,由国家卫健委监管。根据《办法》可知,干细胞临床研究需要由医疗机构发起,在完成医疗机构的临床研究资格备案和项目的备案(简称“双备案”)后,方可开展相关临床研究。
04
MSC疗法近年发展
回顾干细胞技术发展的十余年可以发现,随着我国综合国力的不断提升,干细胞这类新兴技术已成为重点扶持发展对象,国家**各项政策鼓励干细胞产业的发展,如2021年初国家重点研发计划“十四五”总体布局形成,将“干细胞研究与器官修复”纳入“十四五”第一批启动国家研发计划的6个重点专项,持续促进干细胞研究的规范和临床应用的转化;22年国家发改委等九部门联合印发《“十四五”医药工业发展规划》,提出重点发展干细胞治疗;同时各方政府相继**政策为产业持续加码,我国干细胞疗法的监管逐渐由模糊、混乱走向规范化。
在良好政策环境的推动下,干细胞产业市场规模在迅速扩大,预计2026年我国干细胞医疗产业市场规模将达到325亿元(前瞻产业研究院整理)。国际市场层面,根据Transparency Market Research最新报告显示,2022年全球MSC市场规模为32亿美元,复合增长率为12.7%,预计到2031年可以突破101亿美元。
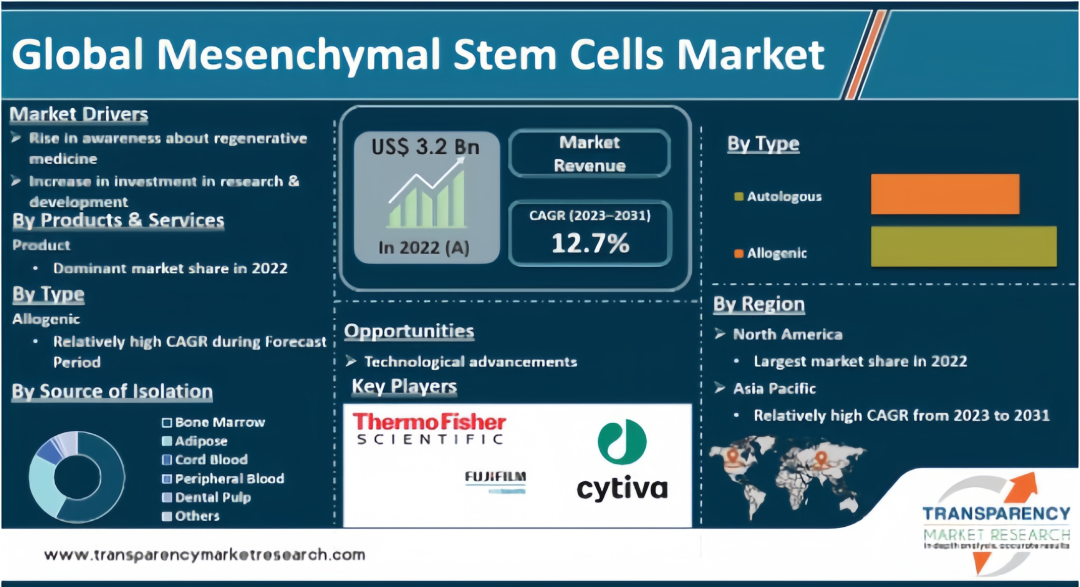 ▲全球间充质干细胞市场
▲全球间充质干细胞市场
05
小结与展望
中国的细胞行业发展离不开政策的支持,政策的一举一动对整个行业的发展带来持续深远的影响。正是因为国家政策的大力支持下,新药研发进入IND阶段的数量才步步上升。
从目前药监局审批速度和项目来看,可以想象未来几年已经过了IND的干细胞药物陆续进入Ⅰ期/Ⅱ期的临床试验会逐步产生临床结果,也许,干细胞作为治疗药物离上市将在不远的未来。
