NEWS CENTER
新闻中心
日本干细胞治疗的临床试验:国家计划下的十年进展
2022年12月,日本国家儿童健康与发展中心先进医学科学部(Division for Advanced Medical Sciences, National Center for Child Health and Development) 的研究人员Shin Enosawa 在行业期刊J Clin Med. (临床医学杂志)上发表了题为Clinical Trials of Stem Cell Therapy in Japan: The Decade of Progress under the National Program(日本干细胞治疗的临床试验:国家计划下的十年进展)的研究报告,报告主要内容概述如下:
干细胞疗法是当前医学科学中的一个世界性话题。各种疗法已根据其有效性获得批准并投入实际使用。在日本,与研发相关的干细胞疗法(通常称为再生医学)一直由政府主导。国家计划始于2002年,自2011年以来,对向临床试验过渡的支持一直在加速。
在临床前研究预算中接受的最初18个项目中,到目前为止,有15个项目已经开始了临床试验。这些包括移植从人诱导多功能干细胞 (iPS) 分化而来的视网膜、**和多巴胺生成细胞,以及从人胚胎干细胞 (ES) 细胞分化的肝细胞样细胞。日本干细胞研究的显着特点是使用iPS细胞。还建立了一个国家框架,以实现最终目标:健康保险覆盖面。现在,保险涵盖用于修复和恢复受损皮肤、关节软骨和中风的细胞移植疗法,以及从国外引进的疗法,例如用于移植物抗宿主病的同种异体间充质干细胞和嵌合抗原受体-T (CAR-T) 细胞疗法。
本文重点讨论了日本干细胞治疗临床试验的过去和现状,重点讨论了国家计划下的进展。
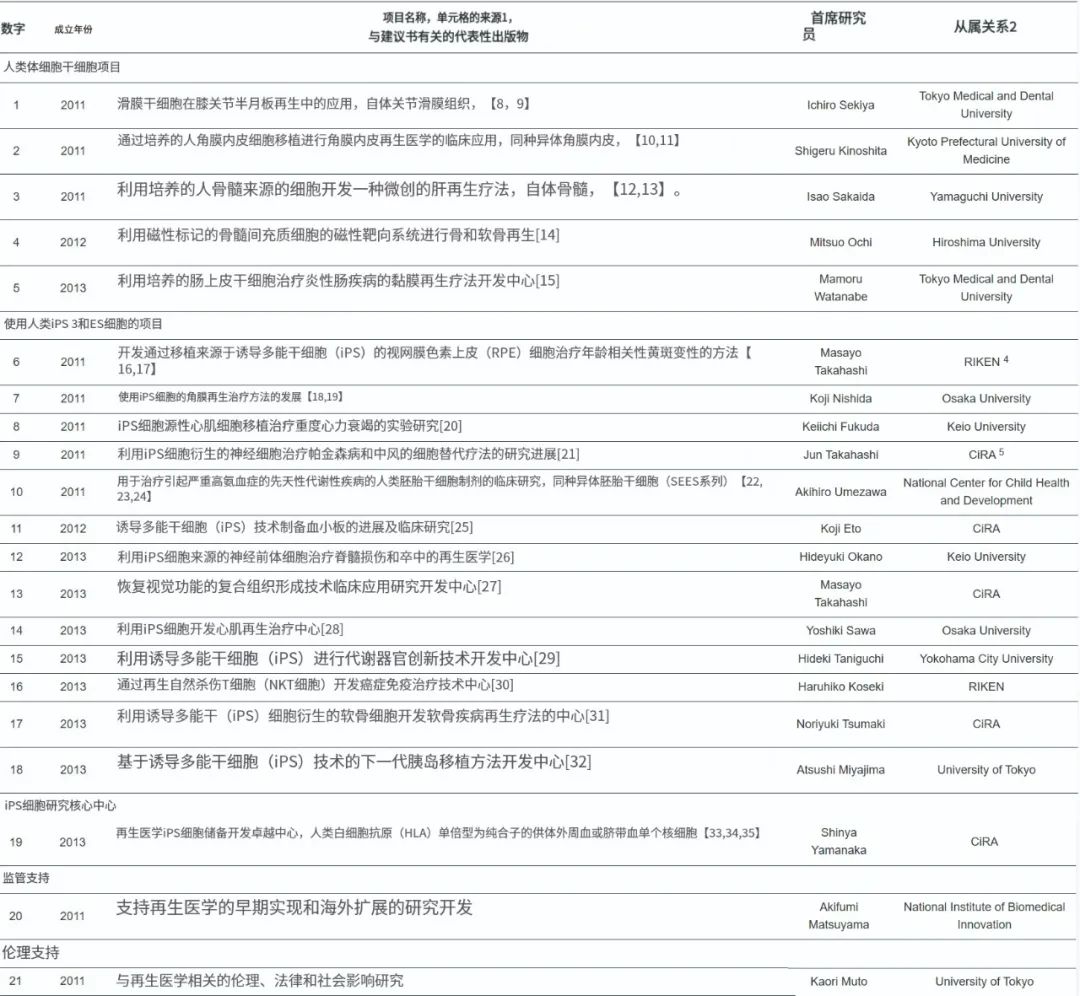
▲表1 实现再生医学的研究中心网络计划的前3年内通过的初期临床前研究项目一览表2011年开始的项目属于实现再生医学的高速公路计划
干细胞治疗临床试验的社会框架
立法
2014年,日本通过了修订后的《关于确保包括药品和医疗器械等产品质量、有效性和安全性的法律》(1960年8月10日第145号法案),其中增加了两个新类别:再生医学产品和基因治疗产品。
再生医学产品包括目前的人体体细胞干细胞和人体体细胞加工产品,引入了有条件和有时限的批准制度。这个制度的目的是在产品被认为有效时就能应用于患者,因为确定再生医学产品的有效性通常需要时间。一旦获得批准或有条件和有时限的批准,使用这些产品的医疗治疗将由医疗保险覆盖。
2014年还颁布了《再生医学安全法》(2013年11月27日第85号法案),根据此法,日本厚生劳动省审查了之前在国家伦理指南下受管制的再生医学临床研究的所有协议。胰岛移植首次根据这项法律进行了手术,并在2021年完成数据评估后,该程序获得了授权并被医疗保险覆盖。
日本医学研究开发机构(AMED)
日本医学研究开发机构(AMED)成立于2015年,作为在医学领域促进研究开发和向商业化过度的总部发挥着核心作用。原先由厚生劳动省、文部科学省和经济产业省**分配的临床定向研究和开发的预算现在由AMED进行分配。AMED还负责规划已批准的研究项目以确保它们得到顺利执行。
iPS细胞储备项目
iPS细胞在干细胞治疗中的优势在于可以使用自体iPS细胞,避免了同种异体免疫排斥的问题。然而,建立iPS细胞系非常耗时且昂贵,尤其是建立符合良好生产规范(GMP)的临床级iPS细胞系。
此外,一个成功的iPS细胞系的获得受个体供体差异的影响,包括年龄。因此,实现再生医学的研究中心网络计划转向使用特制的自体iPS细胞的异基因iPS细胞系。
iPS 细胞库存项目旨在从人类白细胞抗原 (HLA) 单倍型纯合的人中产生一系列 iPS 细胞系 。就HLA-A、HLA-B和HLA-DR而言,这些纯合细胞的相容性比杂合细胞更广泛,140个同源单倍型系将覆盖90%的日本人口。
虽然这些细胞在次要组织相容性抗原中仍然是同种异体的,但排斥反应被认为是轻微的。目前,GMP安全的同型单倍型iPS细胞系用于临床前研究,这些研究处于临床试验范围内的中晚期阶段。
从临床前项目过渡到临床试验
表2显示了从表1所示项目中得出的临床试验列表。所有与体干细胞相关的项目都已经启动,部分成果已经发表。该项目涉及关节软骨的修复从略有不同的角度有四个附属试验 (1-1,1-2,1-3和1-4)。同样,涉及角膜和**再生的项目分别制定了四个和三个协议。这里列出的临床试验是在上述两项法律于2014年颁布后开始的,在此之前也有一些类似的临床研究是在国家伦理指导下进行的。
至于iPS细胞和ES细胞,13个项目中有10个已经开始临床试验。尽管与体干细胞相比,iPS和ES细胞的项目有些落后,但首次人体试验进展顺利。
最先进的是视网膜再生试验,两例自体iPS细胞和五例异体iPS细胞的结果已经发表。最初的计划是用自体iPS细胞设计的,但是由于iPS库存计划的开始,临床试验转向用同种异体iPS细胞。因此,自体诱导多能干细胞的试验在两个病例完成后完成,而目标样本容量为5个。
另一个值得注意的临床试验是Okayama大学医院的Hidemasa Oh为患有致命先天性**病的新生儿进行的自体**细胞移植。他的策略是将从新生儿**成形术中移除的组织中分离出的患者自身细胞移植到**组织中。临床试验在Clinical Trials.gov上注册。作为TICAP预期阶段1,Perseus随机阶段2,ABlon阶段3随机多中心临床试验和TICAP-DCM研究。
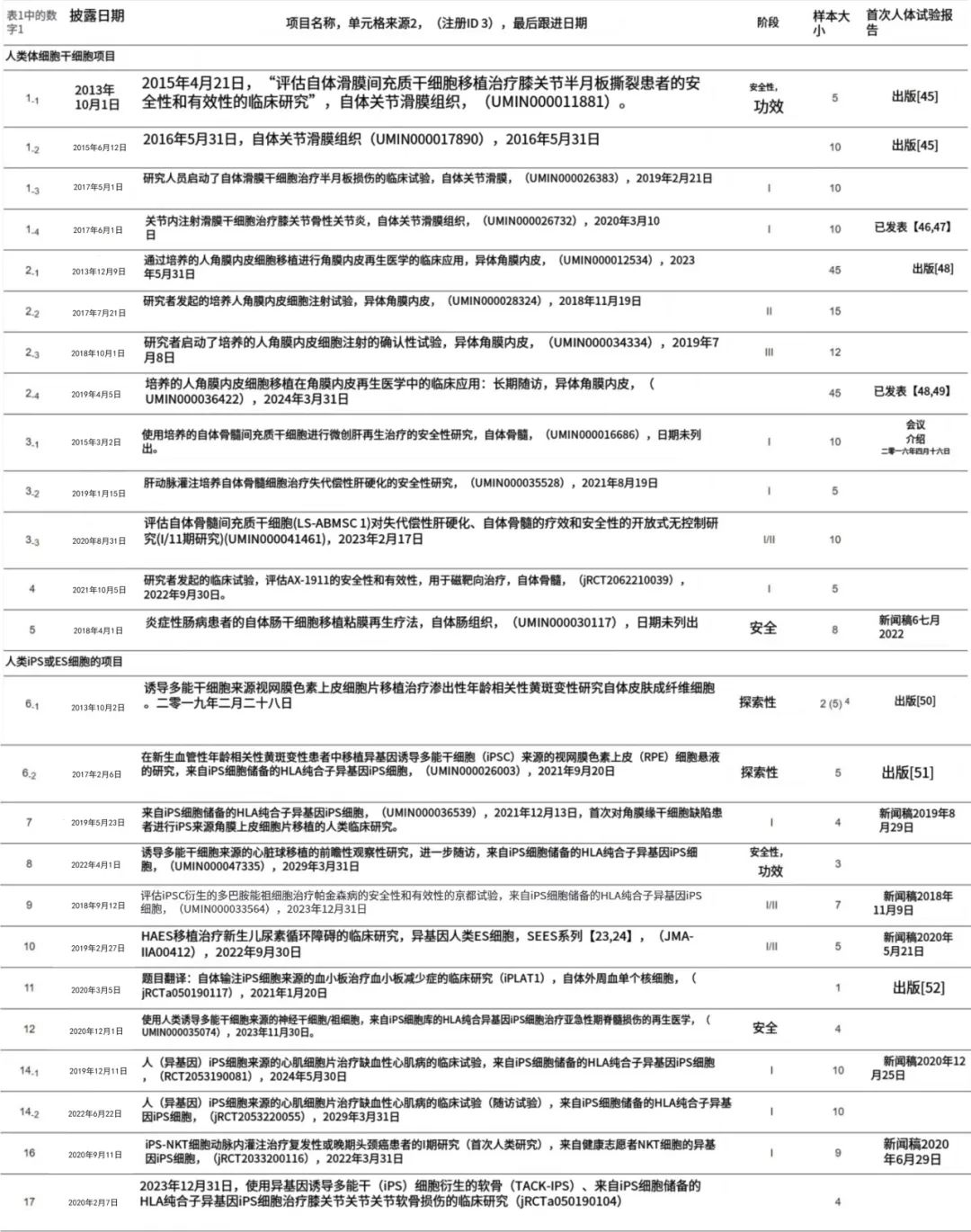
▲表2 来自表1中临床前项目的临床试验列表
批准的干细胞疗法
随着修订后的《药品和医疗器械等产品的质量、有效性和安全保障法》的实施,已有13种细胞加工产品获得批准(表3)。所有产品均基于体细胞或体干细胞的使用,而不是iPS和ES细胞的使用。 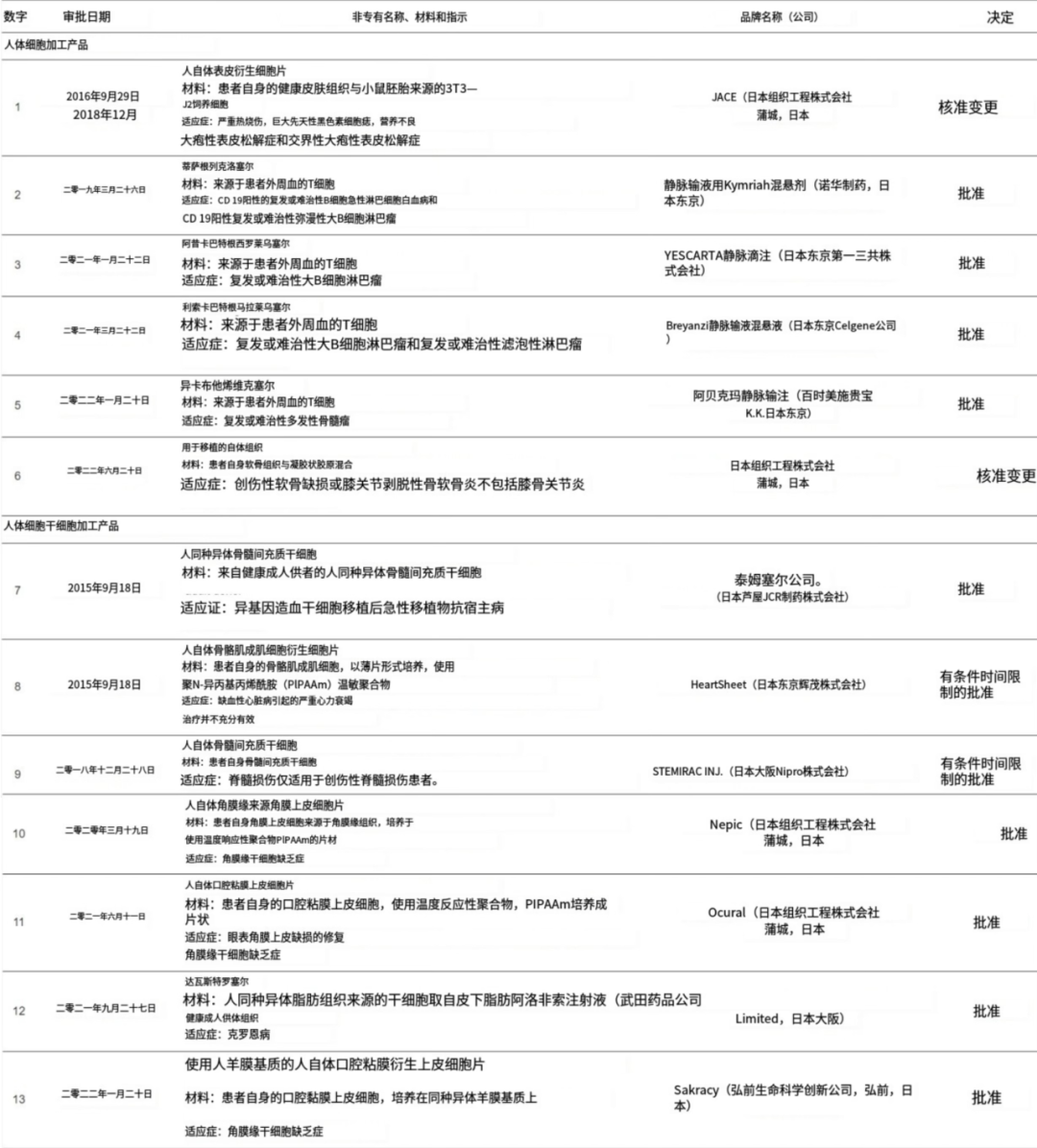
▲表3 根据药品医疗器械等产品的质量、有效性、安全性保障法,日本政府批准的再生医疗产品一览表
Japan TissueEngineering是日本细胞疗法发展的先驱公司,拥有两种已被批准的产品JACE和JACC,已被开发为自体人工皮肤,用于严重热烧伤和软骨缺损。这两种产品分别于2007年和2012年首次获得批准,并于2012年作为医疗器械获得批准,当时未经修订的法案没有再生医疗产品的批准类别。在扩大适应症的重新审查后,两者都被指定为人类成体干细胞加工产品。
国外开发和引进了嵌合抗原受体-T(CAR-T)细胞产品和用于异基因造血干细胞移植后急性移植物抗宿主病的细胞药物TEMCELL。该法案修订后,2015年,TEMCELL和Heartsheet成为第一批被批准为再生医疗产品的产品。HeartSheet是在热响应水凝胶上培养的自体骨骼成肌细胞的细胞片。将这些片材应用于缺血性心力衰竭患者的**表面,以诱导坏死心肌组织的血运重建。Nature 在一篇社论中讨论了 HeartSheet 的有条件批准。已批准7例,预计增至60例。社论提出现阶段是否可以向患者征收医疗费用。希望尽快与 iPS 细胞来源的心肌细胞片一起确定其有效性。
干细胞治疗的下一代研究
临床前研究进展稳定。LOTUS或DREADDs等基因的转移增强了使用人iPS细胞衍生的神经干细胞修复脊髓损伤的能力。除了中枢神经系统外,还报道了使用生物三维打印机和无异种介质进行周围神经再生的有效干细胞治疗。
使用干细胞治疗*脏和肺部的方法也在取得进展。将猪*移植到猴子体内需要强烈的免疫抑制,但胎猪*在临床适用的较温和的免疫抑制下存活。移植的*脏由宿主血管形成血管,这可能作为胚胎器官的互补位点。*脏前体组织,输尿管芽,是由人类 iPS 细胞产生的。
人iPS细胞衍生的肺祖细胞成功整合到小鼠肺中。此外,通过结合软骨、间充质和平滑肌分化,在体外创建了人类气管组织。干细胞治疗的一个新方面是其在脑肿瘤治疗中的应用。胶质母细胞瘤的特征是弥漫性浸润到正常大脑中。表达自杀基因的人iPS细胞具有更高的肿瘤营养迁移能力和抗肿瘤作用,表明基于iPS细胞的治疗侵袭性胶质母细胞瘤的潜力。
诱导组织特异性干细胞(iTS)和牙髓细胞是独特的、有前景的治疗细胞。与iPS细胞类似,iTS细胞是由重编程因子的瞬时过度表达产生的,但由于表观遗传记忆,它们仍然具有对原始细胞的分化方向性。iTS细胞没有表现出完全的多能性,但具有极好的分化方向性。神经嵴来源的牙髓细胞作为干细胞来源引起了人们的关注。那些从乳牙和年轻智齿获得的细胞被认为具有较少的伦理问题和较高的干性。这些研究将在未来十年应用于临床试验。
总结
总之,日本自 2011 年开始实施的一项支持干细胞疗法向临床实践过渡的国家计划,18 个初始项目中的 15 个已开始临床试验。除了研究预算外,还建立了社会框架,如立法、研究总部和iPS细胞库。目前有13种批准的细胞加工产品。细胞治疗不仅要面临有效性的评判,还要面临经济效益的评判。在过去的十年里,再生医疗产品发展到商业化的社会基础设施与全球协调一起建立起来。希望在不久的将来能在这个平台上创造出更好的产品。
